Forschungserfolg gegen Autoimmunerkrankungen
Presseinformation Nr. 22 vom 16. Februar 2012
Biologen der Universität Konstanz legen Kristallstruktur des Immunproteasoms offen
Biologen der Universität Konstanz und des Biotechnologie Instituts Thurgau (BITg) erzielten einen weitreichenden Schritt in der Erforschung autoimmuner Erkrankungen: Den Forschungsgruppen um den Konstanzer Immunologen Prof. Dr. Marcus Groettrup und um den Chemiker Prof. Dr. Michael Groll von der Technischen Universität München (TUM) ist es gelungen, das sogenannte Immunproteasom, das eine zentrale Rolle für die Entstehung autoimmuner Krankheiten spielt, erstmalig zu kristallisieren und seine Struktur zu bestimmen. Damit geben die Konstanzer Biologen grundlegende Anhaltspunkte für die Entwicklung von Wirkstoffen gegen Krankheiten wie Diabetes, rheumatoide Arthritis oder Multiple Sklerose. Die Forschungsergebnisse und die Struktur des Immunproteasoms wurden jüngst im renommierten Wissenschaftsjournal Cell veröffentlicht. Die Molekülstrukturen für diese Arbeit sind an der Synchrotron Lichtquelle Schweiz (SLS) des Paul Scherrer Instituts mittels Synchrotronlichtbestrahlung – einem besonders intensiven Röntgenlicht – bestimmt worden.
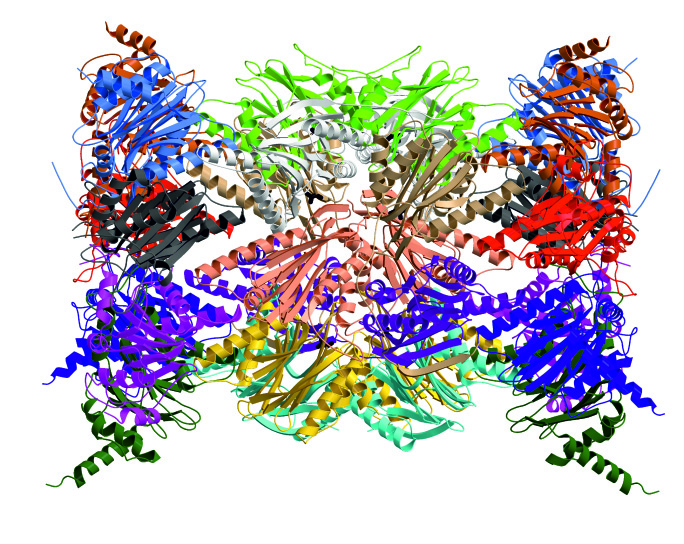
Abb. 1: Kristallstruktur des Immunproteasoms der Maus
Prof. Dr. Marcus Groettrup und seinem Mitarbeiter Dr. Michael Basler gelang es bereits in den vergangenen Jahren, das Immunproteasom als Regulator für jene spezifischen Botenstoffe auszumachen, die autoimmune Erkrankungen verursachen. Eine pharmazeutische Entwicklung von Hemmstoffen, die gezielt das Immunproteasom ausschalten, würde eine Bekämpfung von Autoimmunerkrankungen erlauben, ohne zugleich das gesamte Immunsystem des Körpers zu schwächen.
Bisherige Hemmstoffe konnten jedoch nur auf Basis von sogenannten Peptid-Mimetika erzeugt werden. „Der Nachteil dieser Stoffe ist, dass sie sehr schnell im Körper abgebaut werden und nicht in Tablettenform verabreicht werden können“, zeigt Marcus Groettrup das Manko der gegenwärtigen Wirkstoffe auf. „Für die Entwicklung von wirkungsvolleren Hemmstoffen, die nicht auf Peptidstrukturen basieren, ist die Kenntnis der Kristallstruktur des Immunproteasoms und insbesondere seiner Bindungstaschen wichtig. Auf diesem Wege können effektive Wirkstoffe kreiert werden, die passgenau an das Immunproteasom anbinden“, führt Groettrup weiter aus. Bislang scheiterten alle Versuche einer Kristallisierung des Immunproteasoms jedoch, da keine Präparate mit einem ausreichend hohen Reinheitsgrad gewonnen werden konnten.
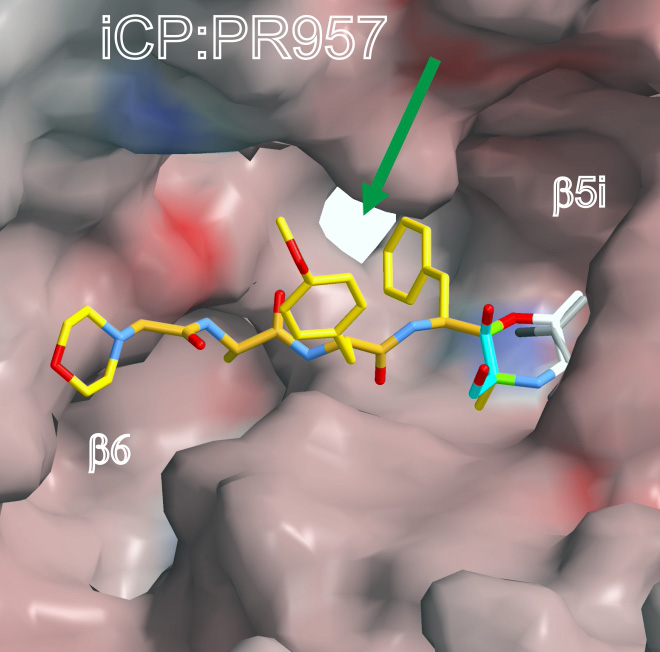
Abb. 2: Bindung eines Hemmstoffs des Immunproteasoms in die Bindungstasche der Immunproteasom-Untereinheit LMP7
Den Konstanzer Forschern gelang es nun, Präparate des Immunproteasoms mit einem Reinheitsgrad von weit über 90 Prozent anzufertigen. Diese Präparate konnten erfolgreich kristallisiert werden, um die Struktur des Immunproteasoms zu bestimmen.
Für die Gewinnung der Präparate haben sich die Biologen eine Beobachtung zu Nutze gemacht: Das sogenannte „konstitutive Proteasom“ in der Leber von Mäusen, die mit dem lymphozytären Choriomeningitis-Virus infiziert sind, wandelt sich innerhalb von acht Tagen fast vollständig in das Immunproteasom um. Hieraus konnten die Forscher ein geeignetes Präparat für die Kristallisierung aufreinigen und erfolgreich die Kristallstruktur bestimmen. Unter Tieftemperatur fixierten die Forscher ferner den Moment des Anbindens der Hemmstoffe an das Immunproteasom und gewannen Aufschluss darüber, welche biochemischen Bestandteile des Hemmstoffs eine besondere Bedeutung für das Bindungsverhalten besitzen.
Im selben Zuge konnten die Forscher auch die Kristallstruktur des konstitutiven Proteasoms bestimmen. Die gewonnenen Strukturinformationen zum Immunproteasom könnten die Basis für eine pharmazeutische Entwicklung von präzisen Wirkstoffen gegen Autoimmunerkrankungen bilden.
Weitere Informationen unter: http://psi.ch/6zwv
Originalveröffentlichung: Huber, E. M., Basler, M., Schwab, R., Kirk, C.J., Heinemeyer, W., Groettrup, M., and Groll, M. (2012) "Crystal structures of the mouse 20S constitutive and immunoproteasome at 2.9 Å resolution". Cell, in press.
