Echtzeitbeobachtung von enzymatischen Prozessen an der DNA
DNA-Strangbrüche können zur Entstehung von Krebs und beschleunigten Alterungsprozessen beitragen. Konstanzer Wissenschaftlerinnen und Wissenschaftler aus den Fachbereichen Biologie und Chemie konnten nun mittels Infrarotspektroskopie in Echtzeit beobachten, welche molekularen Vorgänge bei der Erkennung von DNA-Strangbrüchen ablaufen.
DNA-Schäden im Allgemeinen und DNA-Strangbrüche im Speziellen entstehen tagtäglich in allen Zellen des menschlichen Körpers. Dies geschieht aufgrund von inneren Einflüssen wie freien Radikalen, die während Entzündungsprozessen und der Zellatmung entstehen können, und durch äußere Einflüsse, wie kosmische Hintergrundstrahlung oder auch Röntgenstrahlen im Zuge medizinisch-diagnostischer Maßnahmen. DNA-Strangbrüche können zum Zelltod oder zu Mutationen führen und so langfristig zur Krebsentstehung oder einem beschleunigten Alterungsprozess beitragen.
DNA-Reparatur mittels PARP1
Zellen besitzen molekulare Werkzeuge, um solche DNA-Strangbrüche sehr effizient zu reparieren. Eines davon ist das Enzym Poly(ADP-Ribose) Polymerase 1 (PARP1). Bei diesem Reparaturprozess bindet – als eine der ersten Reaktionen der Zelle auf eine DNA-Schädigung – PARP1 an den Strangbruch und wird dadurch (katalytisch) aktiviert. Mit Hilfe des Substrats Nicotinamid-Adenin-Dinukleotid (NAD+) produziert die PARP1 daraufhin Poly(ADP-Ribose) (PAR), welche ein kettenartiges Biopolymer darstellt. Dieses dient als Signalübermittler in der Zelle und koordiniert die weitere DNA-Schadensantwort. Im weiteren Verlauf des Prozesses löst sich die PARP1 wieder von der Schadensstelle ab und macht so den Weg für nachfolgende Schritte der DNA-Reparatur frei. Dieser Prozess ist insbesondere auch von medizinischer Bedeutung, da pharmakologische Inhibitoren der PARP1 seit kurzem in der Krebstherapie zur Anwendung kommen.
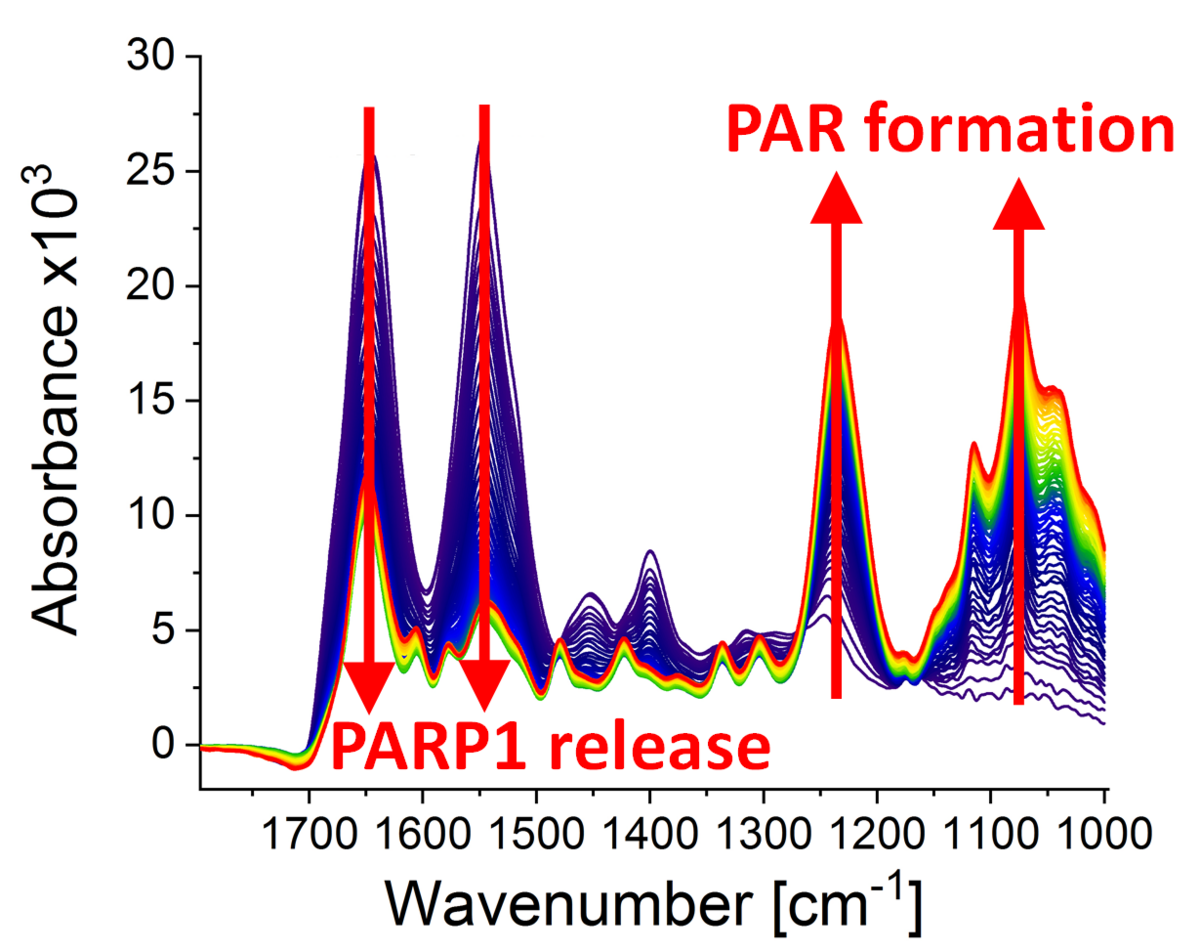
Wissenschaftlerinnen und Wissenschaftler der Universität Konstanz (Arbeitsgruppen Prof. Dr. Aswin Mangerich/Prof. Dr. Alexander Bürkle, Fachbereich Biologie, und Arbeitsgruppe Prof. Dr. Karin Hauser, Fachbereich Chemie) konnten nun die biochemischen Vorgänge, die an einem DNA-Strangbruch unter Beteiligung der PARP1 ablaufen, im Detail sichtbar machen. Sie verwendeten dabei eine spezielle Methode der Infrarotspektroskopie (ATR-FTIR), die auch schon in einer vorherigen, kürzlich publizierten Studie zum Wechselspiel des Tumor-Suppressor-Proteins p53 mit DNA und PAR erfolgreich zum Einsatz kam.
Echtzeitbeobachtungen mittels Infrarotspektroskopie
„Das Besondere an unserer neuen Studie ist, dass wir nun die molekularen Vorgänge, welche die PARP1 an DNA-Strangbrüchen durchläuft, in Echtzeit untersuchen können. Dadurch konnten wir dynamische Veränderungen in der Proteinstruktur aufdecken und so weitere vertiefende Einblicke in die zugrundeliegenden Mechanismen gewinnen“, so Dr. Annika Krüger, die das Projekt im Rahmen ihrer inzwischen erfolgreich abgeschlossenen Doktorarbeit bearbeitet hat. Krüger wurde während ihrer Doktorarbeit durch die Graduiertenschule Chemische Biologie, das Zukunftskolleg der Universität Konstanz sowie den Konstanzer Sonderforschungsbereich 969 „Chemical and Biological Principles of Cellular Proteostasis“ gefördert und forscht mittlerweile am renommierten Karolinska-Institut in Stockholm, Schweden.
Prinzipiell können mit dieser spektroskopischen Methode auch andere enzymatische Prozesse, die an der DNA ablaufen, im Detail und mit molekularer Auflösung untersucht werden. Dies kann langfristig zu einem besseren Verständnis von Mechanismen der Krebsentstehung und Alterung sowie zur Wirkungsweise von Krebsmedikamenten beitragen. Die Studie wurde in der aktuellen Ausgabe der wissenschaftlichen Zeitschrift Nature Communications veröffentlicht.
Faktenübersicht:
- Neue Studie von Konstanzer Wissenschaftlerinnen und Wissenschaftlern der Fachbereiche Biologie und Chemie bietet Einblicke in die molekularen Vorgänge bei der Erkennung von DNA-Strangbrüchen.
- Echzeitbeobachtungen mittels Infrarotspektroskopie liefern Einblicke in den Erkennungsprozess mit dem Enzym Poly(ADP-Ribose) Polymerase 1 (PARP1).
- Wichtige Erkenntnisse zu molekularen Vorgängen mit medizinscher Relevanz, beispielsweise in Hinblick auf die Entstehung von Krebs und Alterungsprozessen oder zur Wirkungsweise von Krebsmedikamenten.
- Originalpublikation: A. Krüger, A. Bürkle, K. Hauser and A. Mangerich, “Real-time monitoring of PARP1-dependent PARylation by ATR-FTIR-spectroscopy”, Nature Communications, 1. Mai 2020. DOI: 10.1038/s41467-020-15858-w.
- Gemeinsame Studie der Arbeitsgruppen Prof. Dr. Aswin Mangerich und Prof. Dr. Alexander Bürkle (Fachbereich Biologie der Universität Konstanz) und der Arbeitsgruppe Prof. Dr. Karin Hauser (Fachbereich Chemie der Universität Konstanz).
- Weiterführende Informationen zur Vorgängerstudie im Online-Magazin der Universität Konstanz, campus.kn.